线虫 qPCR 全流程实操记录:从 RNA 提取到结果分析的完整操作
前言
本文记录了从线虫中提取 RNA、反转录生成 cDNA 到最终进行 RT-qPCR 的完整实验流程。内容包括不同组别线虫的收集清洗、RNA 提取步骤与纯度测定、反转录体系计算方法,以及 qPCR 的体系配置、引物使用与上机操作注意事项。该文章可作为日后重复实验的标准化参考,提高操作效率与结果稳定性。
提取RNA
本次实验设置3个组别,分别为“正常组”“2%葡萄糖造模组”“200μg/ml 余甘子水提物+2%葡萄糖治疗组”。每组共有5个90mm培养板的线虫。线虫数量如图所示
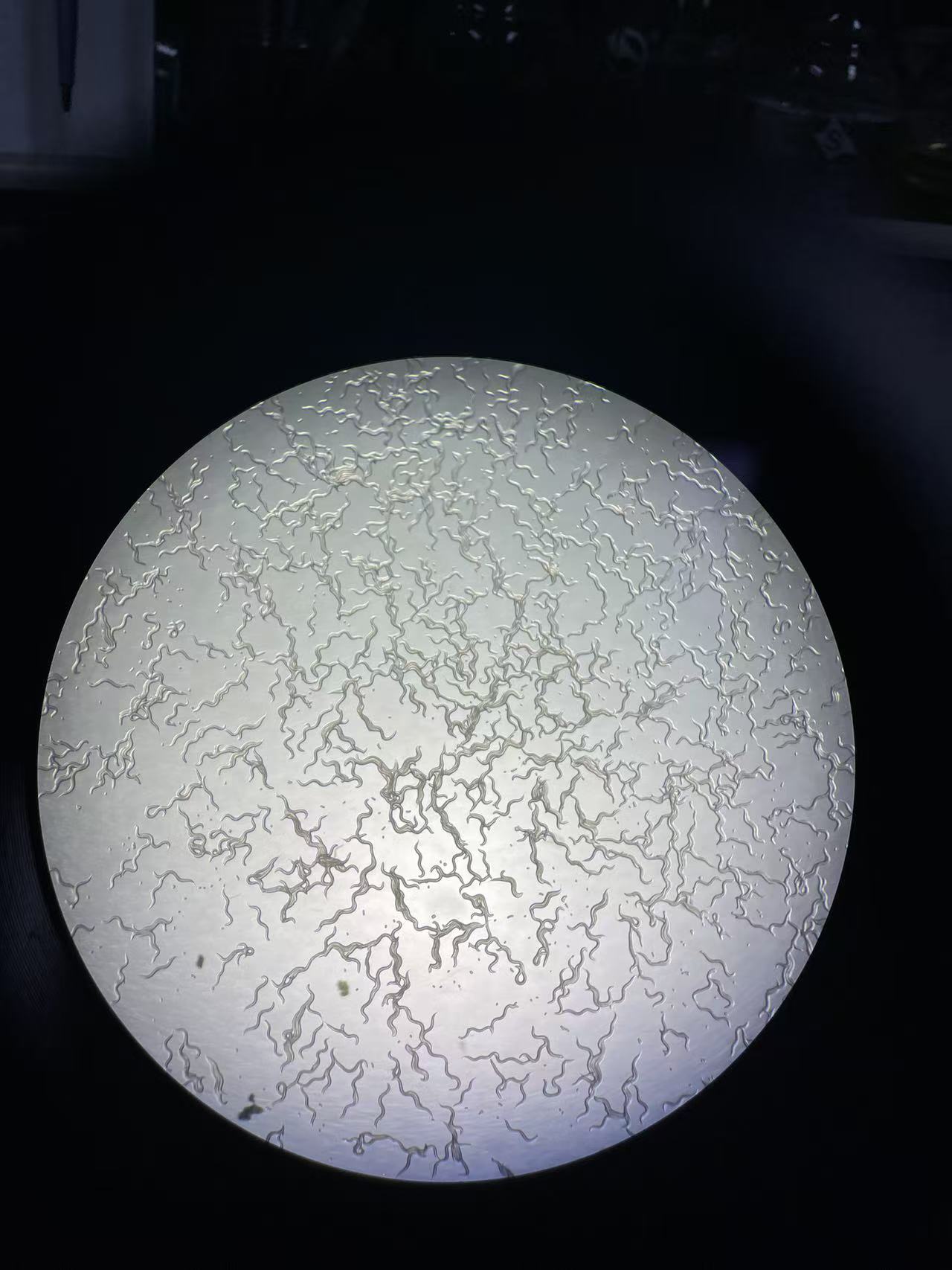
使用M9将线虫全部冲洗下来,反复清洗2次,确保线虫身上的细菌全部清洗干净。置于2ml 研磨管中,尽量吸取上清后备用。

随后使用提取RNA的试剂盒,本次实验用的是UElandy的试剂盒进行实验。

由于所使用的线虫组织量低于20mg,因此R-I、R-II(试剂盒内试剂)和异丙醇的用量都需要减半
往研磨管内添加 200μL的Buffer R-I,反复吹打。而后添加 75μL的Buffer R-II。加入完毕后,放入组织研磨仪进行研磨3分钟左右。
研磨完毕后,将研磨管放入离心机进行离心(12000g,5min)
取上清至试剂盒内提供的离心管。加入125μL的异丙醇进行备用(从这里开始,之后所有操作都需要用无酶枪头)。
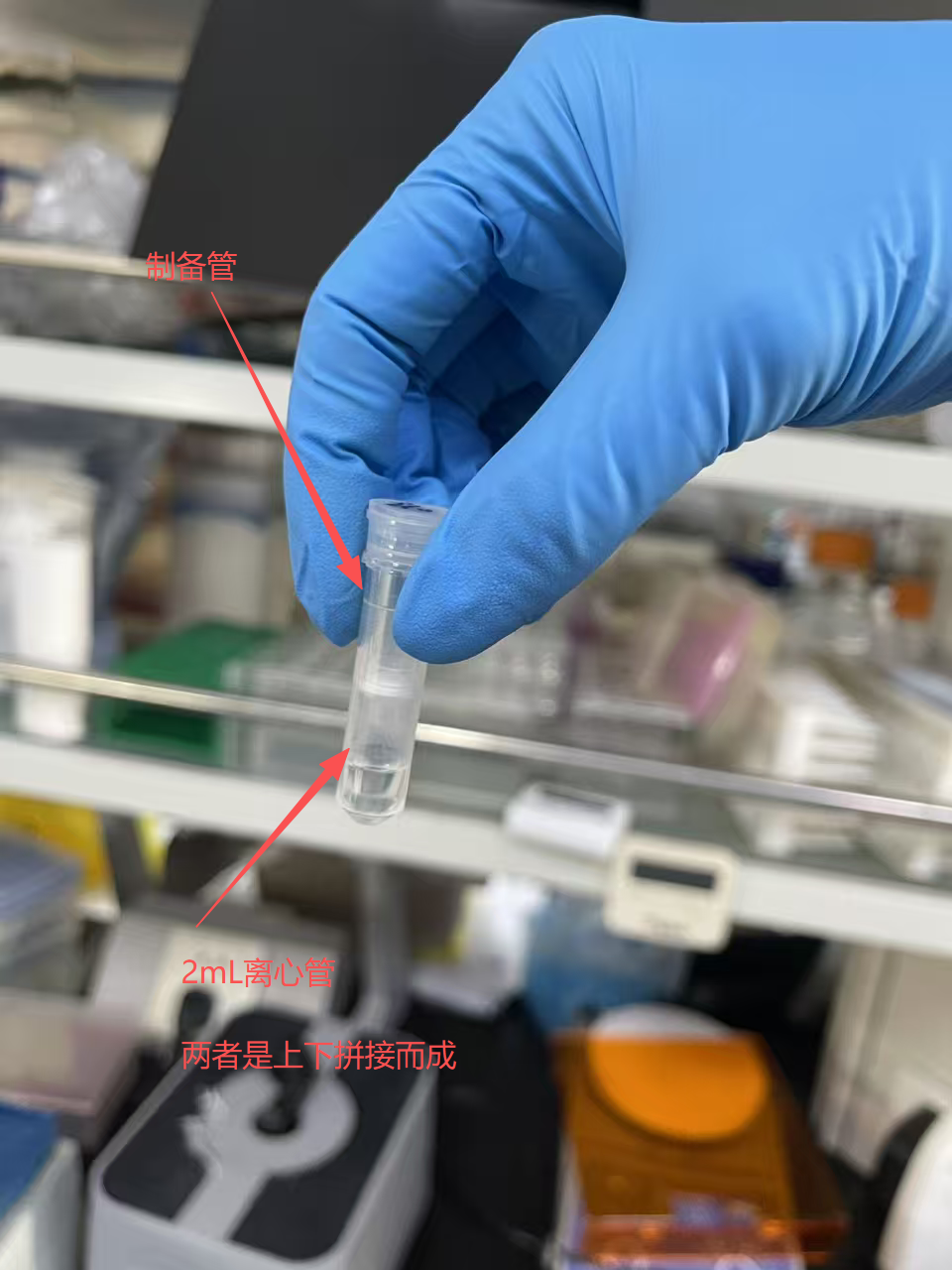
而后按照图片中的步骤进行RNA提取工作:

- 5A. 将制备管置于2 mL离心管(试剂盒内提供)中,转移步骤4中的混合液到制备管中,6,000xg离心1 min。建议在 4℃下离心。
文中所述的制备管与离心管的组合如下:
- 6A. 弃滤液,将制备管置回到2 mL离心管中,制备管中加500 μL Buffer W1A,12,000 x g离心 1 min。
- 7A. 弃滤液,将制备管置回到2 ml 离心管中,制备管中加700 μL Bufer W2,12,000 x g离心1 min; 以同样的方法再用700 μL Bufer W2洗涤一次。
- 8A. 弃滤液,将制备管置回到2 ml离心管中,12,000 x g离心1 min。
- 9A. 将制备管放入干净的1.5 ml离心管 (试剂盒内提供)中,在制备管膜中央加70-100 Buffer TE(DNase & RNase-free)或RNase-free水。
- 10A. 室温静置1min, 12,000 x g 离心1min,洗脱得RNA。
注:此步RNA的保存需放入-80度冰箱
随后需要借助机器测定RNA的纯度

在测试之前,需要拿擦镜纸稍微擦干净探头,先拿Buffer Te当作空白组测定
随后按照自己的组别分别滴定测定,以上滴定都只需要1μL的液体
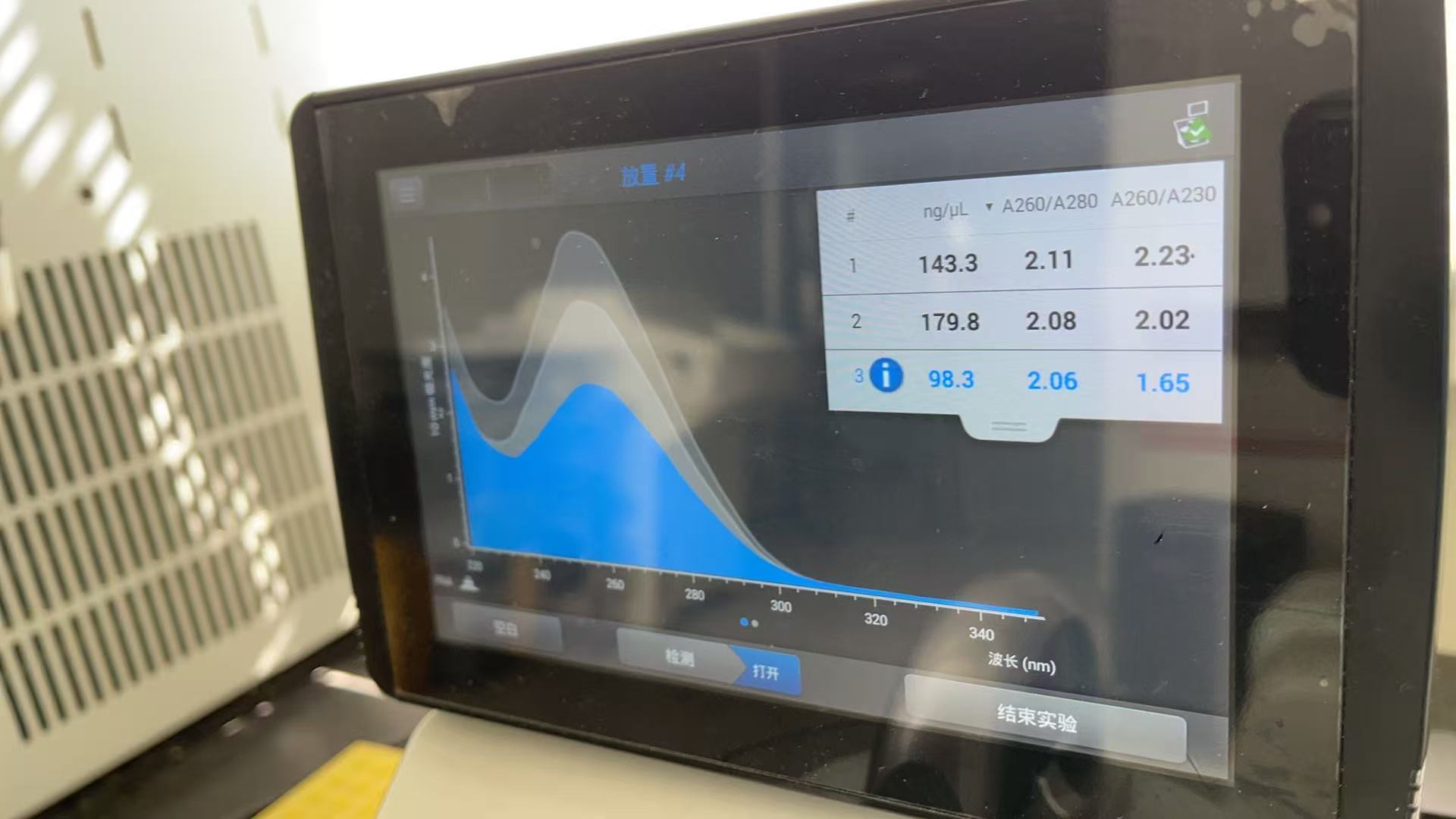
测定结果看A260/280,纯度在2.0 - 2.2是最好的
反转录cDNA
本次反转录为DNA同样也需要试剂盒,本次使用的为Tagara反转录cDNA
| 试剂名称 | 体积 |
|---|---|
| 8 x gDNA Eraser Premix | 2 μL |
| RNA样本 | 1 μg (自行换算为μL) |
| RNA Free H20(无酶水) | 根据前段RNA纯度的数据自行计算 |
| Total | 16 μL |
| ———————————————— | ———— |
| 室温静置5分钟 | |
| ———————————————– | ———– |
| 5 x RT Premix | 4 μL |
| Total | 20 μL |
| ———————————————- | ———- |
| 37℃ 10min,85℃ 5sec, 4℃保温(PCR) |
在这个体系中着重说明一下无酶水以及RNA样本的具体添加量的计算,在前段的体系中需要加入总体积为16μL的液体。根据前面测定RNA纯度所得的每个样本的RNA浓度(ng/μL)进行计算。
在这里以第一行的143.3 ng/μL为例子进行计算。计算需要多少微升(μL)的液体来获得 1 微克(μg)的物质。

四舍五入,则RNA样本处需要加7 μL的液体,那无酶水这一块就只需要加入7 μL就能满足液体总体积为16 μL的要求了。

添加完液体后,放入pcr运行即可。此时可放入4℃暂时进行保存。
RT-qPCR
做RT-qPCR所需要的试剂盒也是Takara的试剂盒:

本次做RT-qPCR所用的体系为,另外还需要准备内参F/R,目的基因引物F/R,以下是每个孔所需要加的试剂:
| 试剂名称 | 体积 |
|---|---|
| SYBR Premix Ex Taq10 μL PCR | 10 μL |
| PCR Forward Primer(0.2 μm)【引物F】 | 0.4 μL |
| PCR Reverse Primer(0.2 μm)【引物R】 | 0.4 μL |
| cDNA | 0.4 μL |
| ddH2O | 8.8 μL |
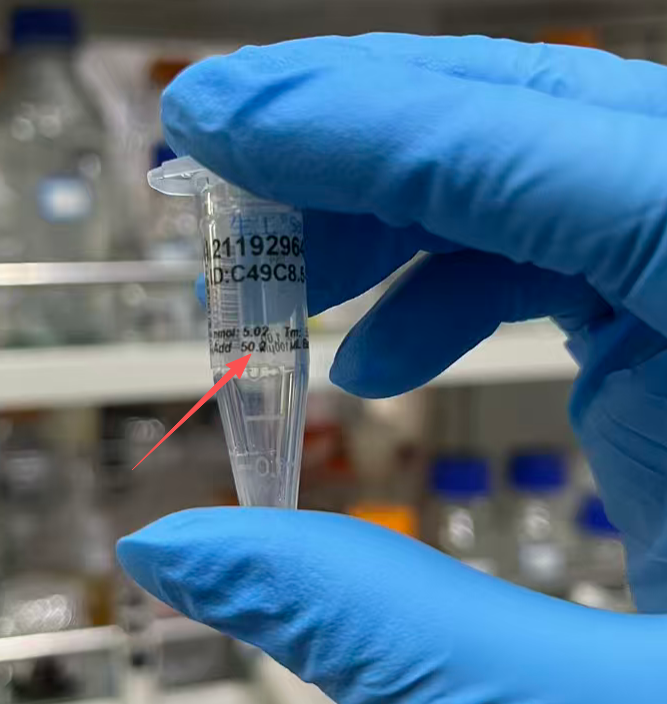
在正式实验之前,先用无酶水把引物溶解了,每个引物所要加入的量一般会写在离心管中:
若是给每个孔都一遍遍这样加就显得非常麻烦。建议按照需求,统一配比统一加入。如我这里有3个目的基因+1内参 ,在qpcr的板子上是这样的(N、2%、200表示的是组别;act、z-5、C49、C05表示基因;三个孔是技术重复):
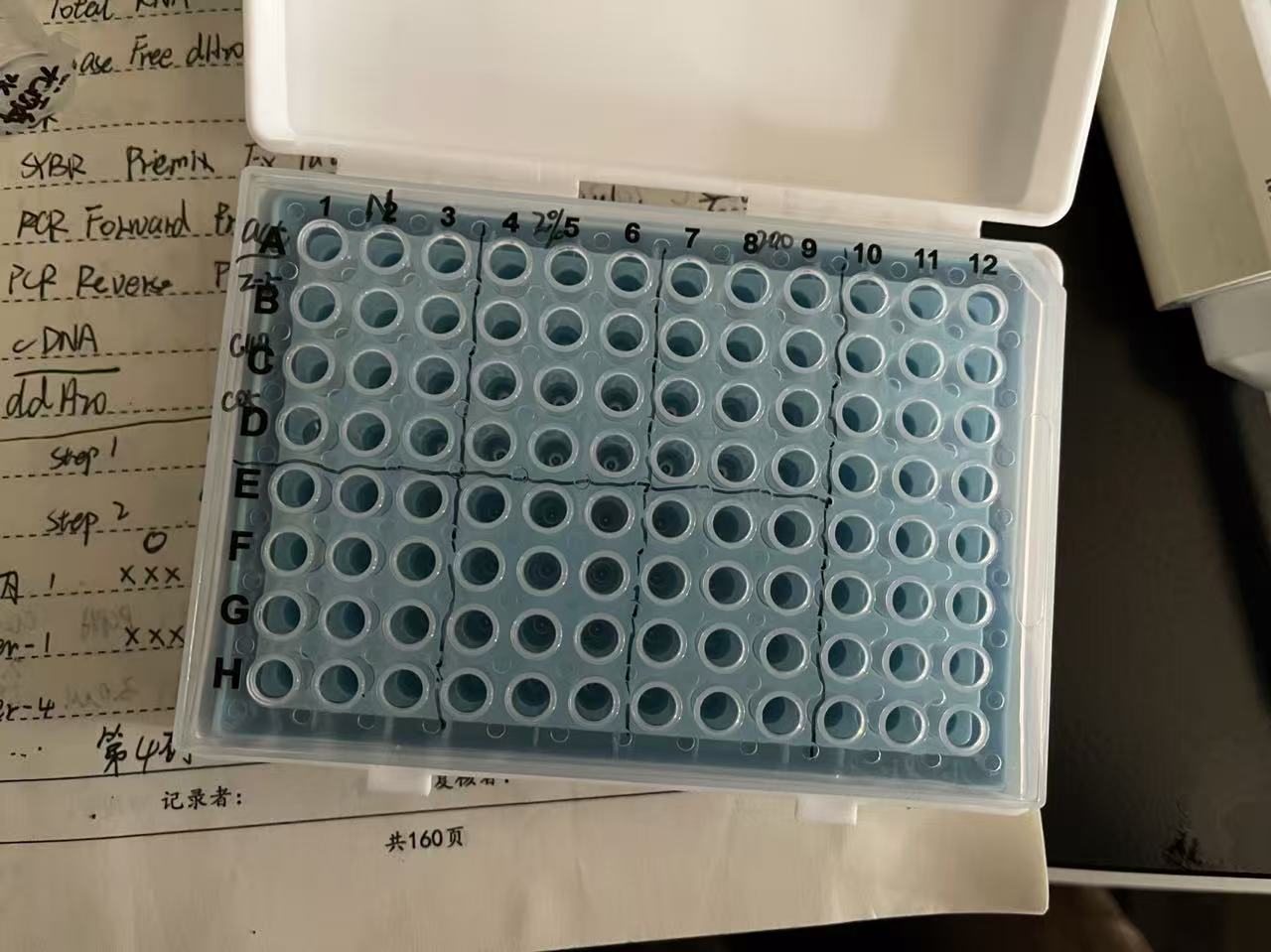
可以先按照孔位先提前混合 cDNA+H20;SYBR Premix Ex Taq + 引物(F)+ 引物(R)后,统一加入孔中,这就按照个人需求自行配比了
注:需要借助机器混合,另外还要离心一下,以免液滴粘附在壁上
加完孔后需要给板子封膜,再统一混匀



摇匀后再借助甩板机离心一下,以免液滴粘附在壁上,尖尖朝外

甩完后即可上机进行RT-qPCR的测定,机器上详细的参数就需要根据需求去调整了
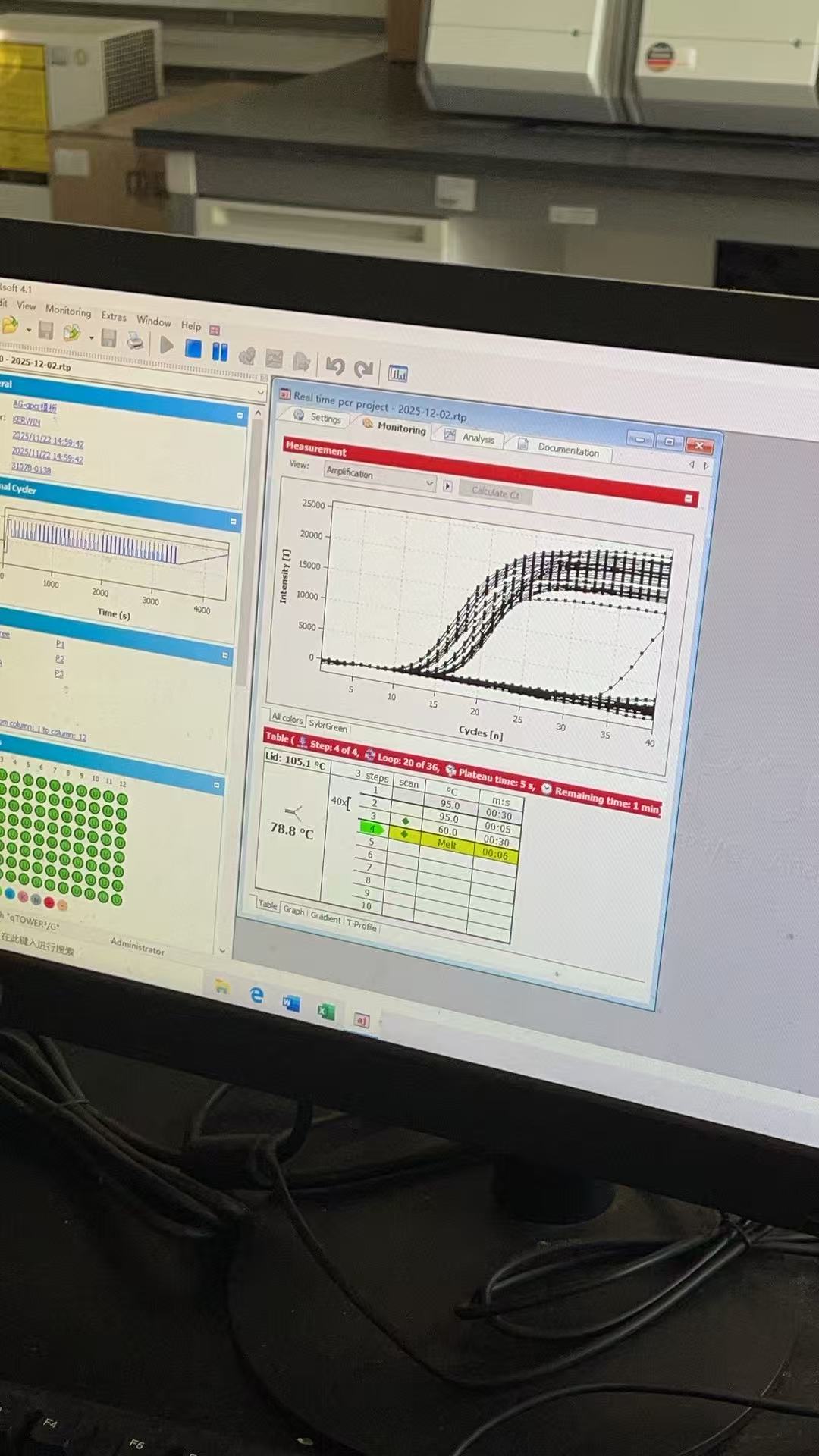
另外每个机器其导出的数据和使用方法不一样,所以得因地制宜。唯一相同的点是都需要导出含ct值的表格,像这样:
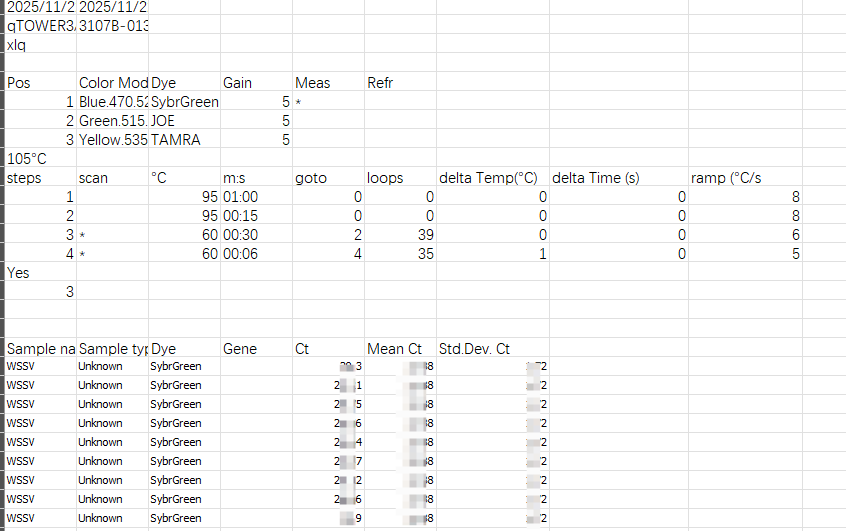
获取后自行查看B站作图即可