下载C.elegans目标基因序列
在WormBase(https://wormbase.org/#012-34-5)搜索所需要的基因
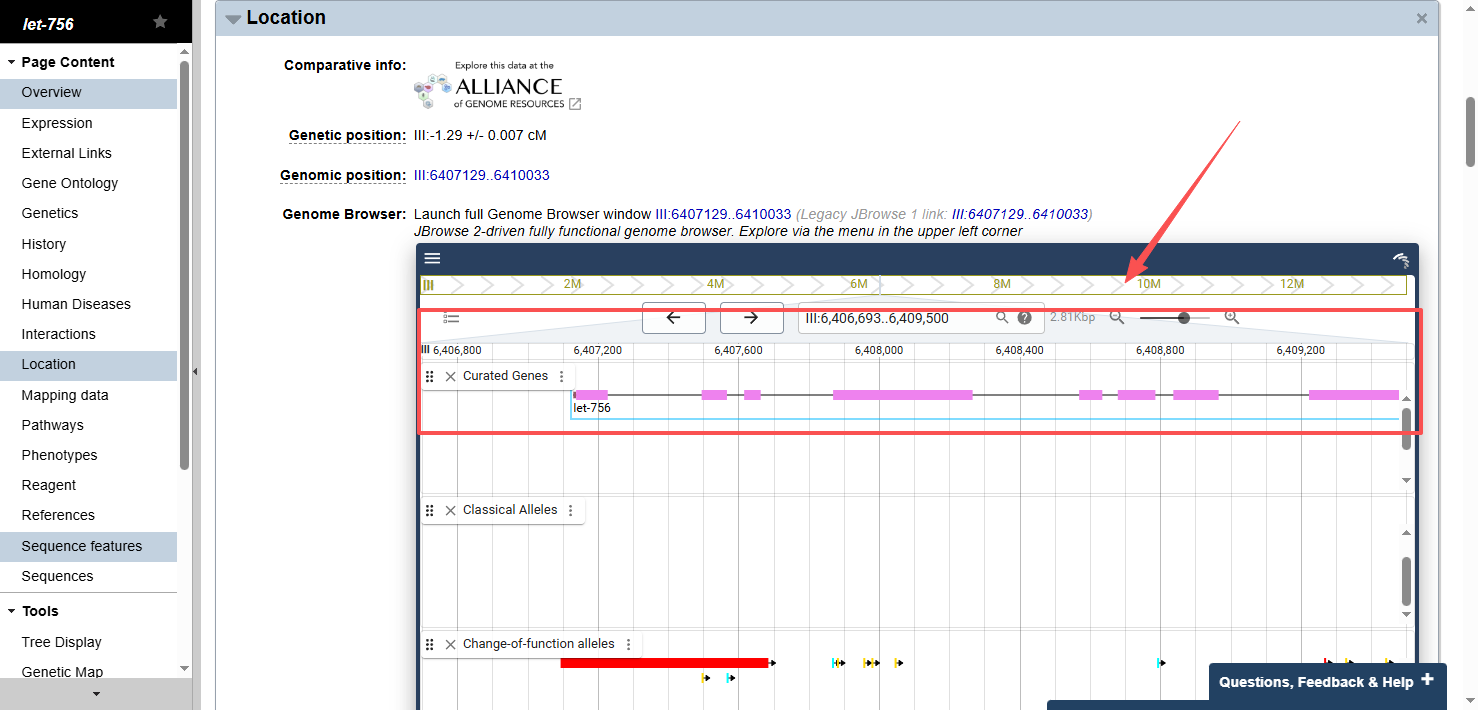
点击这个框,往下拉,注意type上写cDNA的才是我们所要的
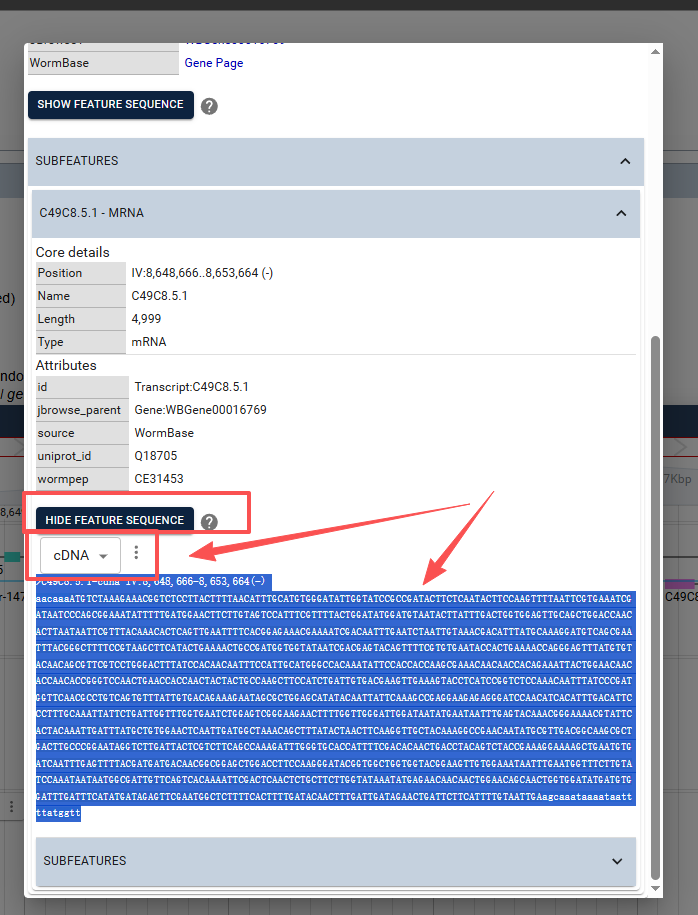
这块就是我们的目标基因,复制保存为fasta文件,其他基因同样也是这个步骤进行复制
使用Primer-BLAST设计引物
进入ncbi官网(https://www.ncbi.nlm.nih.gov/)点击右栏的Blast,拉到下面
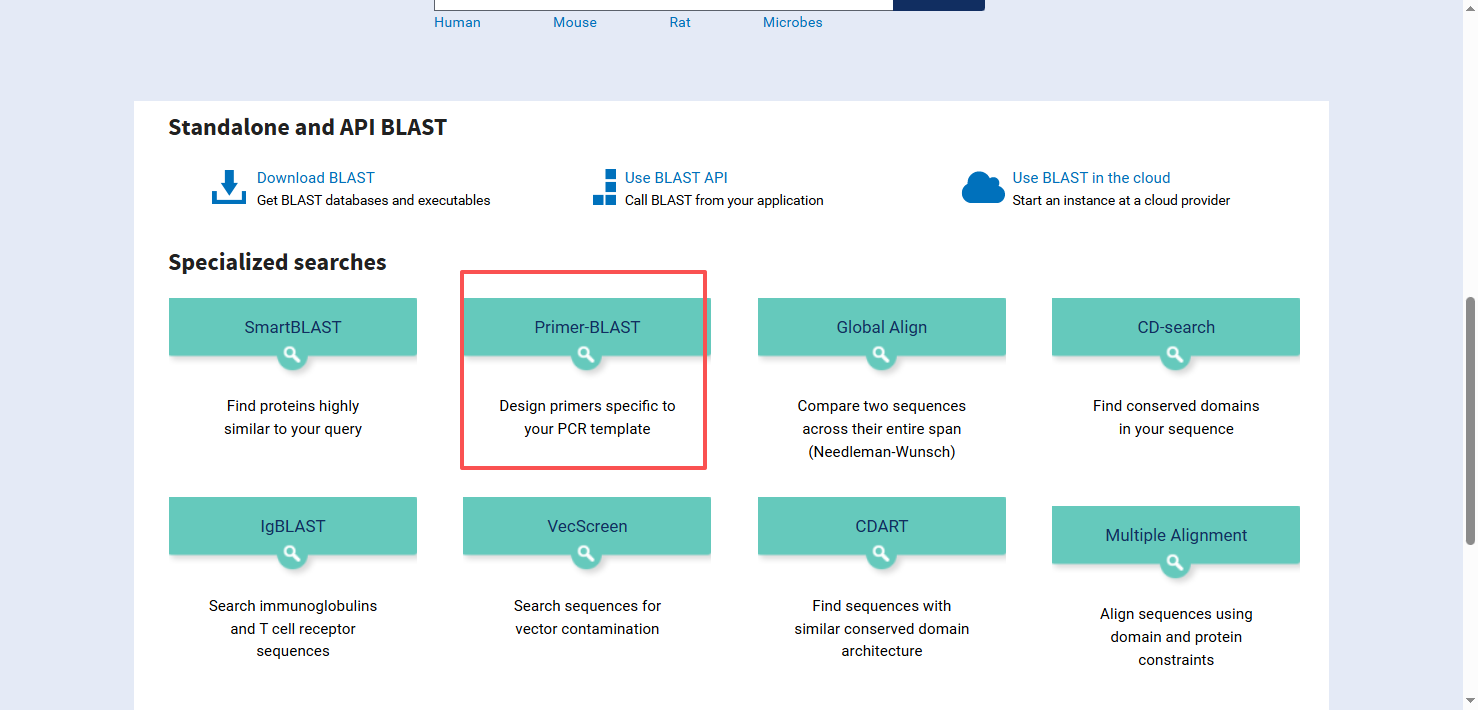
点击Primer-BLAST
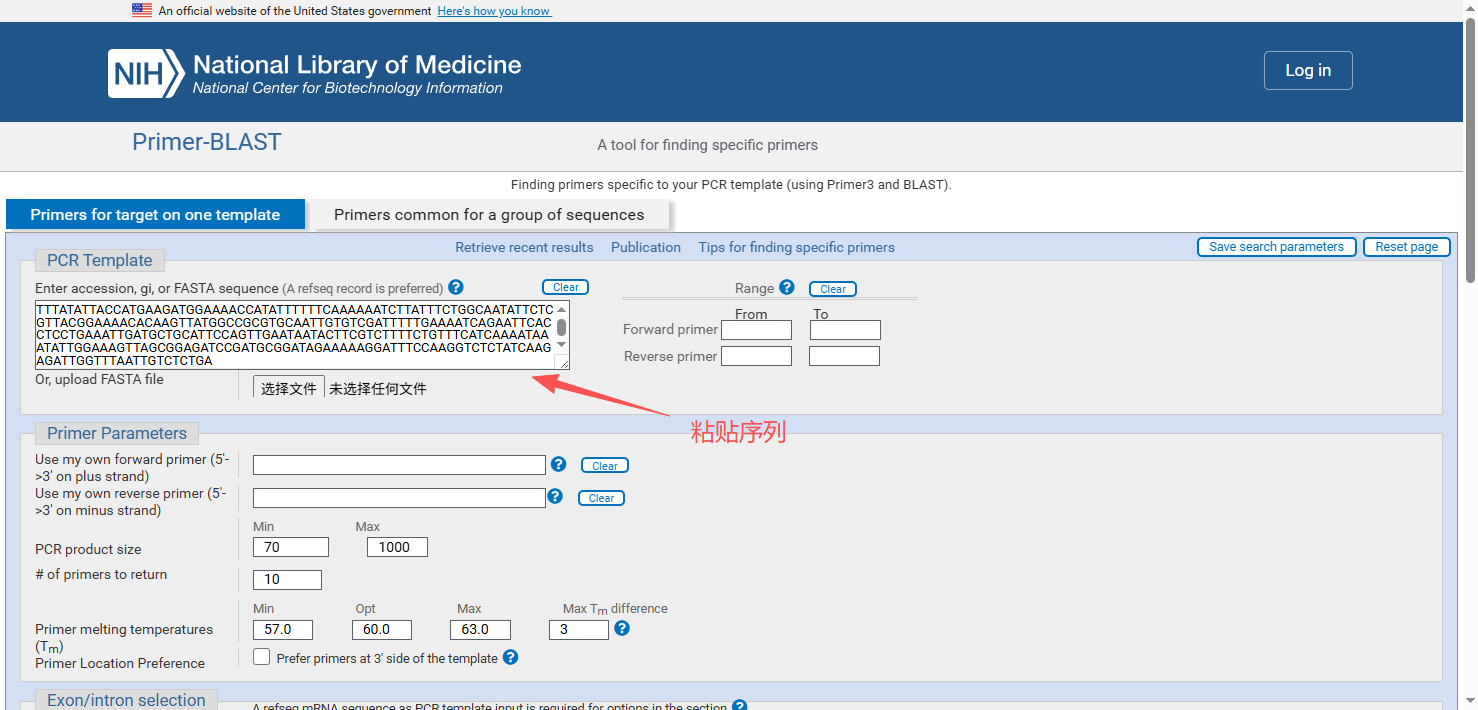
粘贴序列
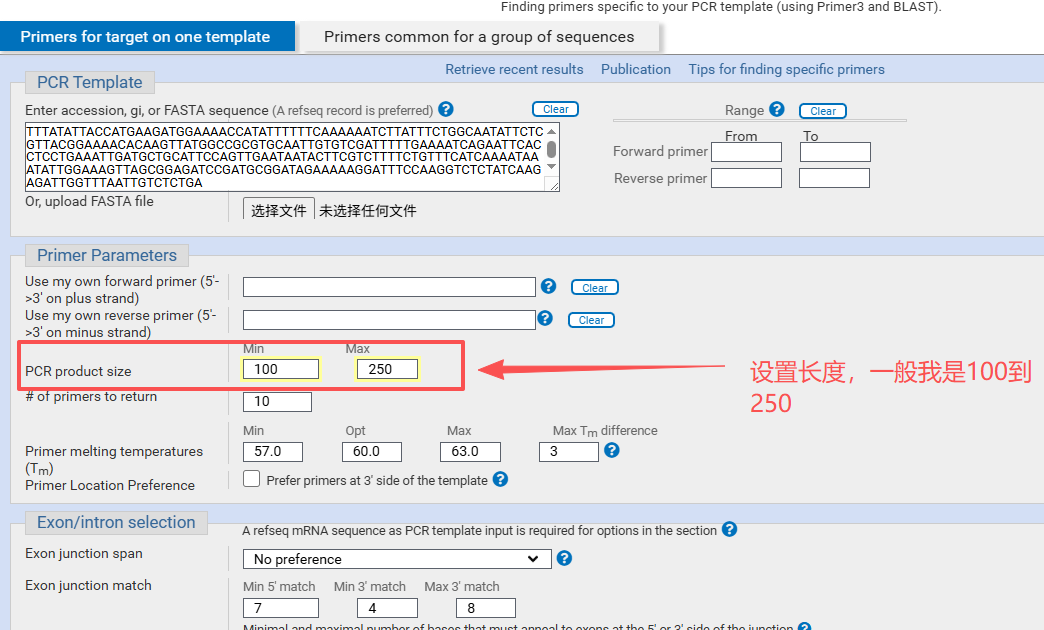
设置引物的长度
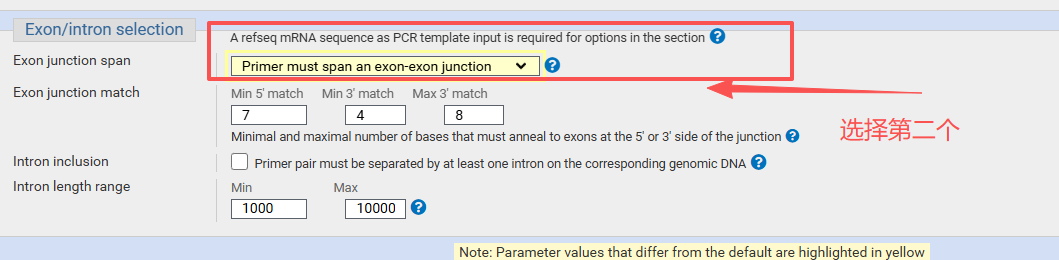
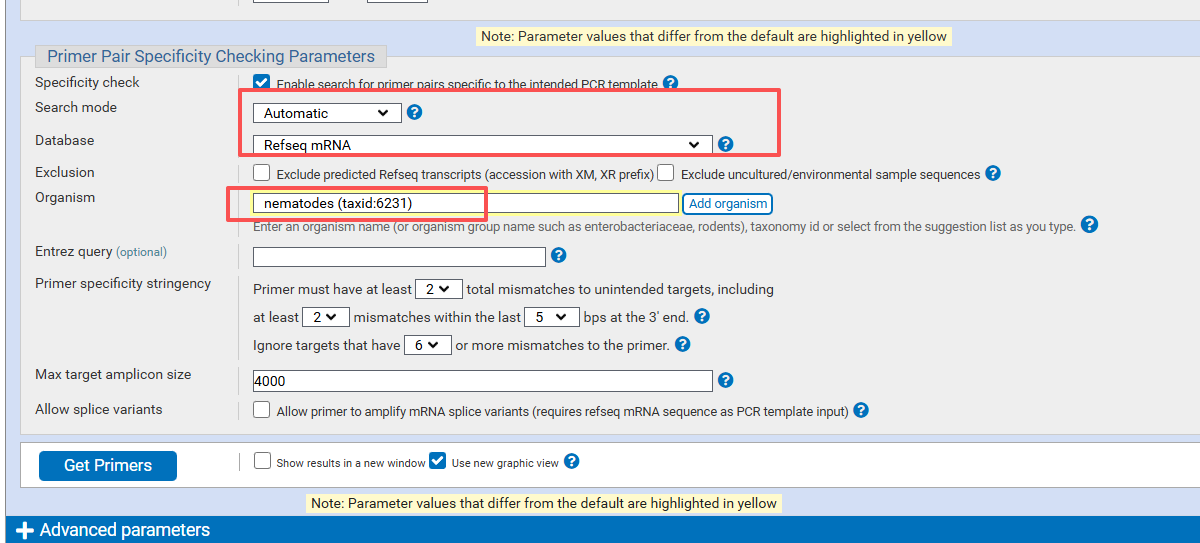
注:秀丽隐杆线虫在ncbi里面是nematodes (taxid:6231)
选择物种和形式
设置完后点击Get Primers
稍等一会后我们会获得结果
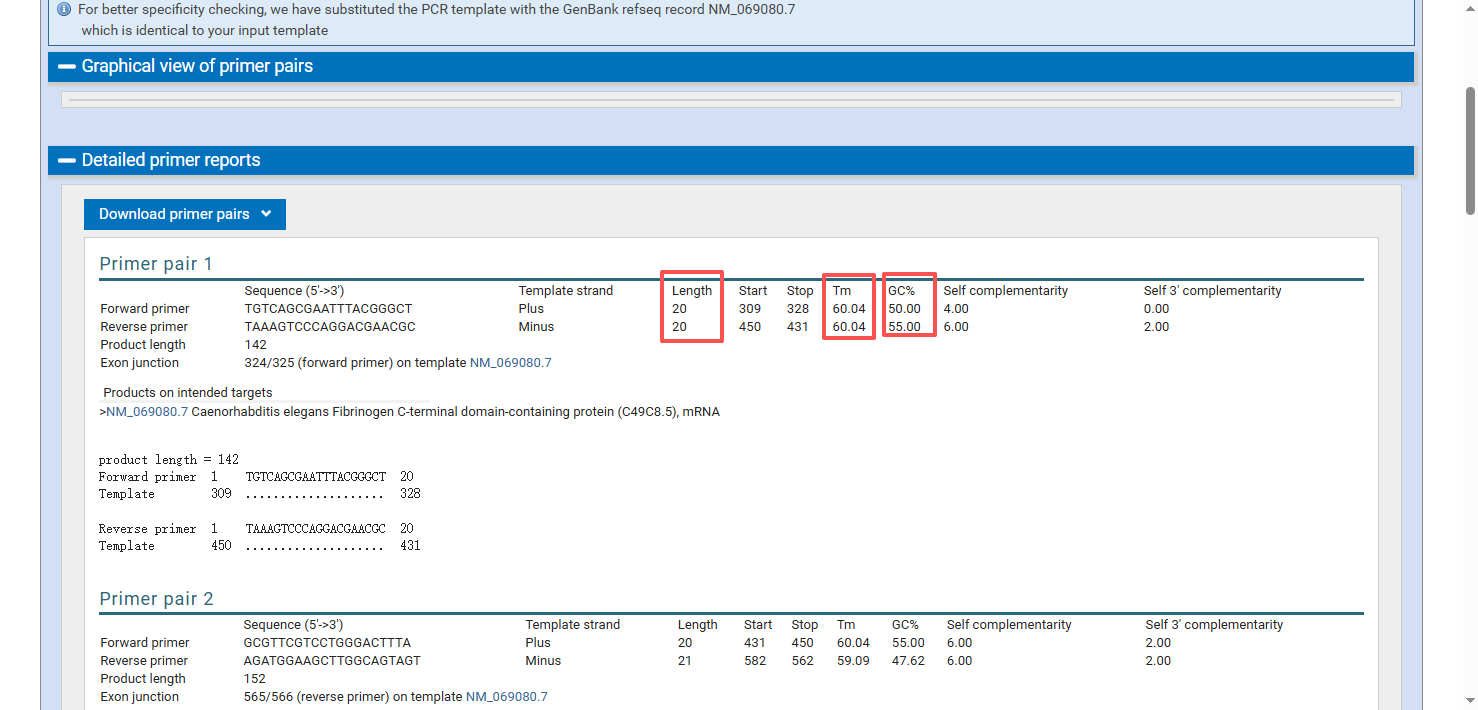
需要注意的是,引物Tm值在55-65%,引物GC%在40-60%,引物长度18-25nt之间,即为理想的引物
点击Download primer pairs即可下载引物列表
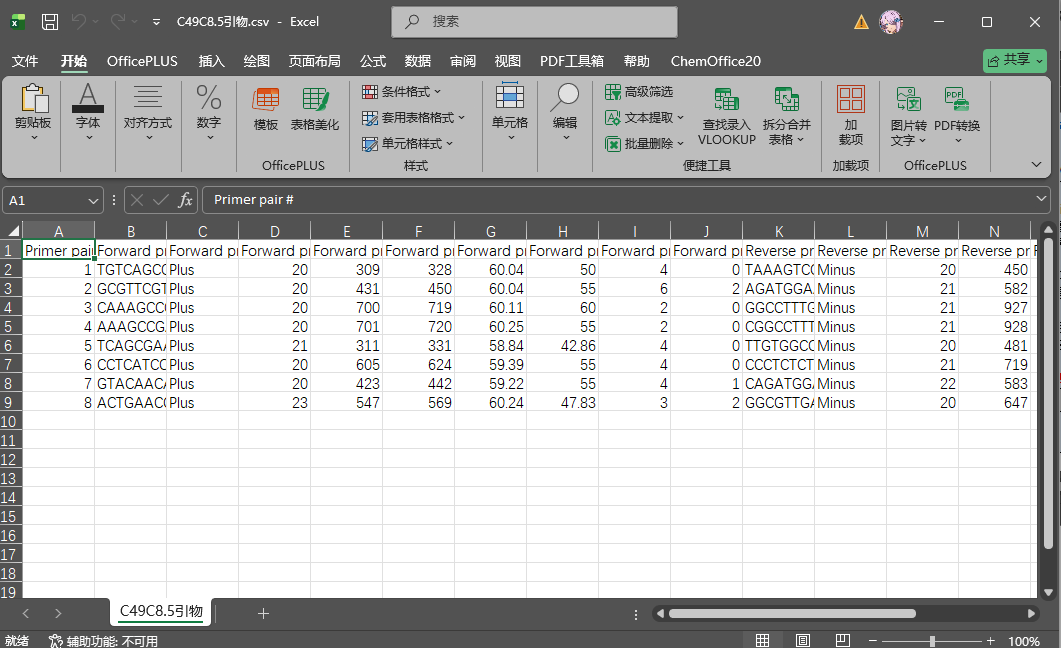
之后拿去做qpcr即可
相关推荐
2025-12-02
线虫 qPCR 全流程实操记录:从 RNA 提取到结果分析的完整操作
前言本文记录了从线虫中提取 RNA、反转录生成 cDNA 到最终进行 RT-qPCR 的完整实验流程。内容包括不同组别线虫的收集清洗、RNA 提取步骤与纯度测定、反转录体系计算方法,以及 qPCR 的体系配置、引物使用与上机操作注意事项。该文章可作为日后重复实验的标准化参考,提高操作效率与结果稳定性。 提取RNA本次实验设置3个组别,分别为“正常组”“2%葡萄糖造模组”“200μg/ml 余甘子水提物+2%葡萄糖治疗组”。每组共有5个90mm培养板的线虫。线虫数量如图所示 使用M9将线虫全部冲洗下来,反复清洗2次,确保线虫身上的细菌全部清洗干净。置于2ml 研磨管中,尽量吸取上清后备用。 随后使用提取RNA的试剂盒,本次实验用的是UElandy的试剂盒进行实验。 由于所使用的线虫组织量低于20mg,因此R-I、R-II(试剂盒内试剂)和异丙醇的用量都需要减半 往研磨管内添加 200μL的Buffer R-I,反复吹打。而后添加 75μL的Buffer R-II。加入完毕后,放入组织研磨仪进行研磨3分钟左右。 研磨完毕后,将研磨管放入离心机进行离心(12000g,5...
2025-08-13
多浓度线虫高糖培养基配方记录
记于2025-6-11 要求(100 mg/mL母液浓度,配制400 mL培养基的目标浓度),使用稀释公式 C₁V₁ = C₂V₂ 计算各浓度所需母液体积(单位:μg/mL与mL需统一) 具体计算如下: 🔢 关键参数 母液浓度 (C₁)****:100 mg/mL = 100,000 μg/mL(1 mg = 1000 μg) 目标体积 (V₂)****:400 mL 目标浓度 (C₂)****:25、50、100、200、500 μg/mL 需加母液体积 (V₁)**:按公式 V₁ = (C**₂ × V₂) / C₁ 📊 计算结果 目标浓度(μg/mL) 需加母液体积(μL) 计算公式与过程 25 100 μL (25 × 400) ÷ 100,000 = 0.1 mL = 100 μL 50 200 μL (50 × 400) ÷ 100,000 = 0.2 mL = 200 μL 100 400 ...
2025-09-21
秀丽隐杆线虫油红O响应值测定方法
前言在做秀丽隐杆线虫实验的时候,我们往往需要对线虫测定脂肪分布,这时候可能需要使用油红O染色法测定线虫脂肪滴的分布,在这里就简易地说一下测定的方法。 实验准备需要有ImageJ软件、油红O线虫染色的照片如图所示: 测定过程打开ImageJ 其软件界面如图所示: 首先点击Analyze——Set Measurement.. 按图选择所需要的指标: 点击OK 打开线虫染色的图片 点击File——Open——选择照片 图片RGB转灰度处理 点击Image——Type——8-Bits 此时图片变成灰度图: 将图片反转选择 点击Edit——Invert 此时图片变成如下图所示: 设定阈值 点击Image——Adjust——Threshold 按照所需要的数值进行调整,尽量将线虫染色的区域囊括进去 随后点击 对线虫本体进行框选 测定响应值 框选完毕后测定响应值,点击Analyze——Measure 得出测定油红O的响应值,一般文献会选择线虫的平均光密度 也就是平均光密度=IntDen / Area 在这里的数值为:152.035, 和Mean值基本相同,...
2025-11-21
线虫培养、同步化及相关培养基制备指南
记录于 2025-4-21对现有的实验方案进行部分调整 LB 培养基固体需加琼脂粉 15 g/L(250 mL 加 3.75 g) 配方(1L / 250 mL) 1L 250 mL NaCl 5 g 1.25 g 胰蛋白胨 10 g 2.5 g 酵母提取粉 5 g 1.25 g 使用 1M NaOH 调 pH 7.5,121℃ 高压灭菌。 NGM 培养基(铝箔包装) 成分 1L 400 mL 100 mL NaCl 3.0 g 1.2 g 0.3 g 细菌蛋白胨 2.5 g 1 g 0.25 g 琼脂粉 17 g 6.8 g 1.7 g 去离子水 975 mL 390 mL 97.5 mL 121℃ 高压灭菌,冷却至 55℃ 后加入: 添加剂 1L 400 mL 100 mL 胆固醇 (5 mg/mL) 1 mL 0.4 mL 0.1 mL 1 M CaCl₂ 1 mL 0.4 mL 0.1 mL 1 M MgSO₄ 1 mL 0.4 mL 0.1 mL 1 M KPO₄...
2025-12-16
秀丽线虫油红O染色的实战心得与实验方案
前言线虫油红O测定是做线虫脂质代谢研究中不能不品的一环,在这里分享一下自己做油红O染色的心得 实验材料准备 线虫(数量20-30条) 油红O染色试剂盒 M9缓冲液 步骤油红0工作液的制备 根据样品数量及每个样品所需的染色工作液的体积,按油红0溶液与油红0稀释液 3:2 的比例配制油红 0染色工作液。然后用 0.45 微米的水系针头滤器过滤,两小时内使用。 实验过程 根据实验目的,培养大量所需时期的秀丽线虫; 洗涤: 将板上线虫挑至(冲洗)到离心管,用 M9缓冲液洗涤线虫 2-3次,自然沉淀 染色: 每个管中加入 200 μL油红0工作液,避光染色约1个晚上(个人比较喜欢晚上染色,第二天早上拿出来测定) 脱色: 首先使用试剂盒中的洗涤液冲洗,待自然沉淀后,使用含 0.01%(20ml加 2ul) Triton-X100 的 M9 缓冲液清洗3次,不要用离心机沉淀虫子,让其自然沉降(直至无色),离心弃上清,最后一次剩一点的液体(液体越少越好),冲洗到这种程度就差不多了 5、拍照:随后将离心管里剩下的液体和线虫全部转移至 2%琼脂糖胶垫上,即可拍照 琼脂胶垫一般个人是用枪头滴2滴在...
2025-09-26
二代测序数据基础分析(一)
技术介绍 第二代测序技术,1990s - 2010s 第二代测序技术从原理上分为三种方法: Roche 454测序法 IIIumina Solexa/Hiseq测序法 ABI Solid测序法 三种二代测序技术的对比: 总结 二代测序技术总体而言都有着同一种特性: 需荧光或化学发光物质 需聚合酶或连接酶 需购买昂贵的试剂耗材和光学系统 需强大的图形分析计算能力 WES分析流程WES分析流程分为5个步骤: WES分析流程 数据质量控制 序列比对分析 变异检测 变异注释 一. WES分析流程原始测序数据——数据质量控制——序列比对——变异检测——变异注释——完成 二. 数据质量控制数据质控标准: 去掉reads中的接头 去除低质量(BP<20)碱基的reads 去除序列头尾的N碱基 去除头尾N碱基后若剩余reads长度小于40bp(双端),则丢弃该对序列 原始数据下载——sratoolkit软件 123456# 安装conda install sra-tools# 找到sra数据,下载srr listprefetch SRR1139956# sra...
评论